

第二种方法是 SpectraPlex 独特的创新方法,该方法基于部分染色样本的参考建议。这种方法显著减少了生成参考数据所需的生物材料量,同时也缩短了制备与成像时间。该新方法利用每个荧光团的理论光谱信息生成初始串扰矩阵。仪器设置的仿真基于这些输入,生成适用于拆分矩阵参考成像的标记物子集分组(图 3a)。拆分数据采集分为两步:第一步,根据串扰矩阵和标记物子集的光谱分布生成成像设置,并采集接近无串扰的结果;第二步,评估这些子集的有效光谱贡献(包括其相对强度)(图 3b)。随后,在完整面板设置下进行采集,实现 15 重标记样本中所有荧光团的成像。通过结合首次接近无串扰数据和完整 15 重标记数据(面板参考数据),生成最终的拆分矩阵(图 3b)。
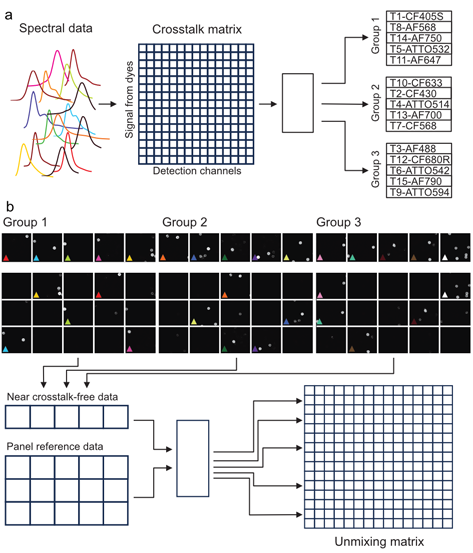
a,通过结合理论光谱计算得到的串扰矩阵以及可能的硬件设置排列,生成包含标记物子集的分组(此处为三张部分染色样本),以获得接近无串扰的信号。实验室可以相应地制备这些参考样本,随后进行两步数据采集。
b,首先采集接近无串扰数据集(上排),随后进行对应的完整染色(15 通道)成像(下排),以显示完整面板中信号的相对分布。每组的两次数据采集结果相结合,并用于拆分算法,生成最终的拆分矩阵(详细信息见正文)。
对于这三种方法,参考图像中的感兴趣区域(ROI)会被自动选定,用于提取光谱特征。用户可以根据需要审查、调整或修正特定通道的感兴趣区域,以确保信号的最高准确性和保真度(图 2b)。单一染色参考法和完整面板染色法是目前大多数拆分方法中常用的经典策略(单一染色参考方法的示例见文献 5,6,盲拆分方法的示例见文献 7,8)。在 SpectraPlex 中,完整面板法是一种半盲拆分方法,基于输入光谱以及系统和实验设置信息作为起点。
我们的专有分组法值得更详细的描述(图 3)。其数学描述基于一般的线性拆分框架,涉及四个向量:A、R、M 和 U。其中,A 表示采集图像通道的强度,c 为图像通道索引,C 为通道数量。R 表示拆分结果,d 为标记物索引,D 为荧光染料数量。M 为混合矩阵:
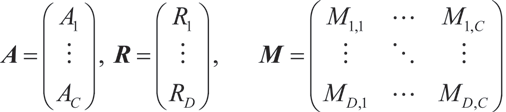
在完整的多标实验采集中,标记物的信号会发生串色。因此,M 将拆分结果 R 中各荧光染料的信号转换为采集图像 A 中每个像素 p 的检测信号,其中 P 为像素数量:
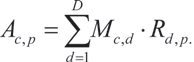
线性拆分通过拆分矩阵 U 对采集到的强度进行反向转换:
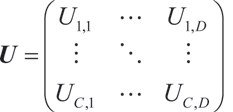
其中,U 是混合矩阵 M 的转置逆矩阵:
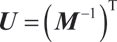
在此框架中,函数 t 将部分染色参考样本的通道映射到最终多标设置的通道,而函数 T 提供用于构建部分参考分组的标记物数量:
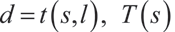
使用参考分组采集的图像强度用向量 G 表示(针对每个像素 p),而完整多标设置采集的图像强度则用向量 F 表示:
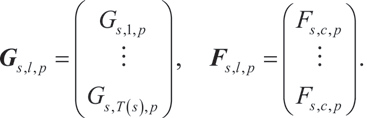
我们旨在使参考分组采集的接近无串扰图像 G 与完整多标设置采集图像 F 之间的差异平方和最小化:
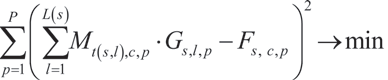
需要注意的是,当后续实验步骤中获取的通道集合保持相对强度不变时,某个特定的拆分参考采集在整个实验中仍然是有效的。然而,尽管样本的制备采用相同的流程并且标记物的用量一致(理想情况下在一个主混合液中),从对照组到样本组之间在实际操作中仍可能存在显著的变异。这种情况下,可能需要调整整体信号强度,但不能破坏各个通道之间的平衡。SpectraPlex 通过全局强度调整功能解决了这一关键问题,确保了所有通道信号的整体平衡。



