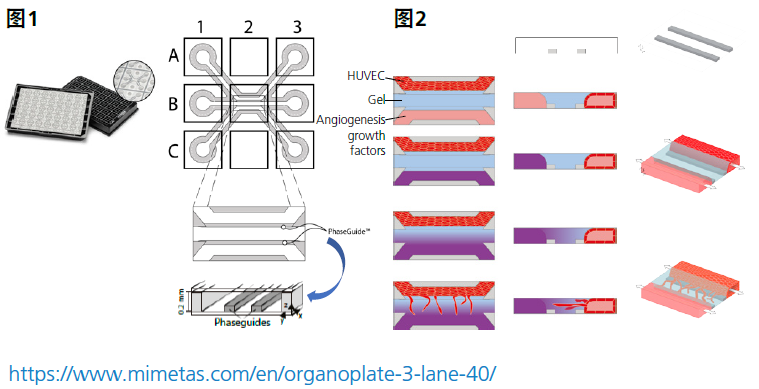
众所周知,血管的稳态功能下降关系到多种疾病和病理状况的发生和发展,如癌症、动脉硬化、慢性炎症和缺血。在此背景下,了解微血管损伤和血管新生的详细机制是非常重要的。本应用手册将介绍一个3D血管新生结构(利用体外灌注血管生成模型)的详细观察和分析实例,该实验借用于MIMETAS公司的3D组织培养平台OrganoPlate®,并使用Nikon激光共聚焦显微镜AX/AX R系统采集图像。
实验结果
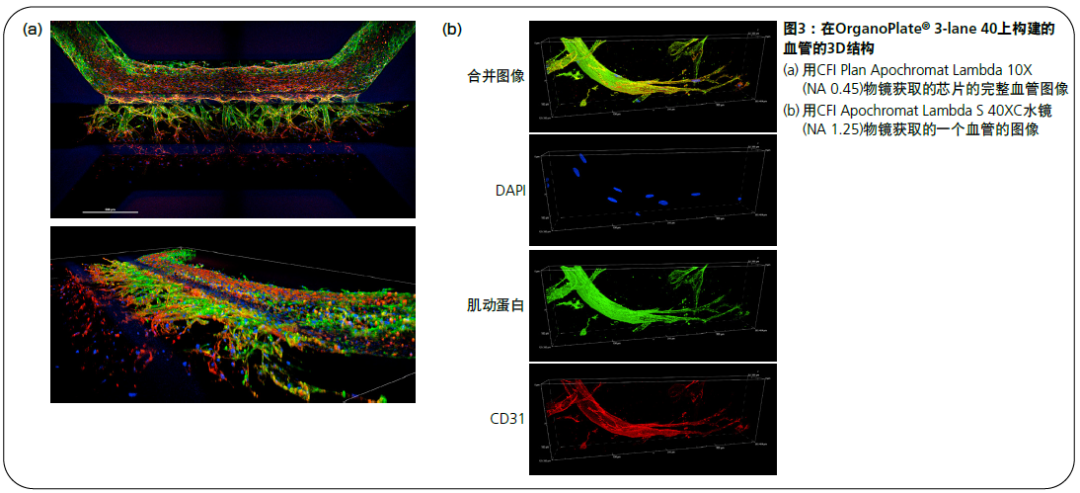
为了观察血管尖端的形态及其组成细胞的定位,对肌动蛋白和CD31(血管内皮细胞的标记物)进行了染色。通过适用于培养基或凝胶中的样品的水浸式物镜来获取组织的3D图像,图像明亮清晰,可以检测出肌动蛋白和CD31定位的差异(图3b)。这表明,该方法通过使用符合观察目的的物镜,以研究参与血管生成的各种细胞,如尖端细胞(tip cell)、茎细胞(stalk cell)和方阵细胞(phalanx cell)。
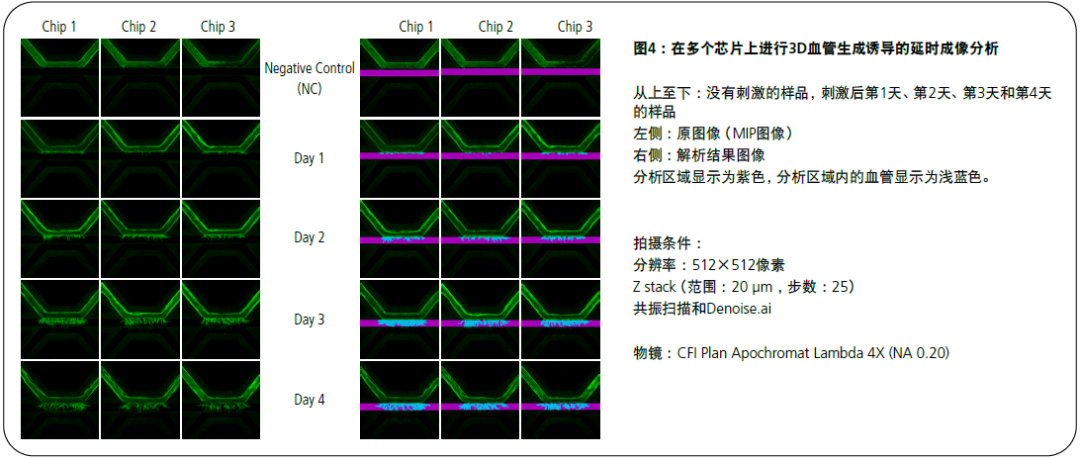
高通量对于逐个芯片检测是否存在血管生成非常重要。使用4倍物镜可以通过一次拍摄来观察整个芯片(图4)。通过使用显微镜的AI模块Denoise.ai,可以在维持共振扫描的高速性的同时,获取低噪声的XY-Z图像,从而通过图像分析实现定量评估。
此外,Nikon NIS-Elements 软件可以对2D图像和3D图像进行定量分析。在图5中,使用细胞核的数量、肌动蛋白区域的体积和CD31区域的体积来分析凝胶区域的血管生成的三维分布。

Nikon 激光共聚焦显微镜AX/AX R系统成像视野可达25mm(对角线),可以通过一次拍摄获取大面积的图像。同时,使用共振高速扫描仪和 Denoise.ai,也可减少获取多个芯片图像的时间(图4)。并且,经证实,使用适当的物镜可以详细观察单个血管的形态和其组成细胞的3D排列(图3b)。此外,图像分析工具GA3能够对血管生成进行定量评估(图5),这些结果表明,该系统可应用于要求有高通量的、3D血管生成模型的毒性和药物疗效评估。
产品信息
共聚焦显微镜AX/AX R
图像采集分辨率可达8K×8K, 是以往型号的4倍。大视野25mm(对角线)允许一次捕获大面积的图像,减少光毒性。AX R的共振扫描仪分辨率可达2K×2K,可以每秒720帧(2048×16像素)高速采集和捕捉活样本的动态变化和精细结构。


