
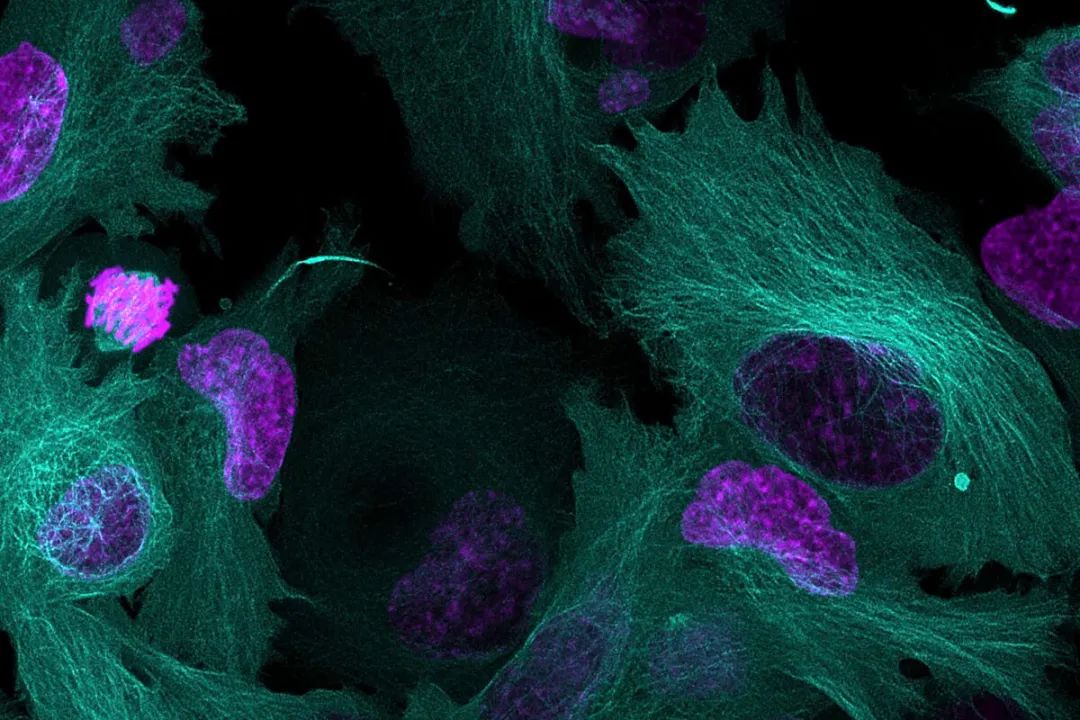
在活细胞显微成像中使用多通道方法可以同步观察多个细胞结构和过程,提供生理学方面更重要的结果,从而为测量数据增加相关信息。通过这种方法可以研究细胞与蛋白质相互作用、动态变化以及这些变化如何相互作用和影响。不过,使用单个荧光团的实验很常见,而使用两个或多个荧光探针对活细胞成像可能会很复杂,并且必须仔细考虑几个要点才能成功。本文将介绍有关成功设置多色活细胞实验的一些关键方面。
设置多色活细胞实验时,首先要选择合适的荧光团,这一点至关重要。荧光团必须与活体样本相容,并具有光稳定性,才能进行长期成像。荧光蛋白标记、活细胞染料、动态标记(如 Ca2+ 指示剂)及其他用于标记感兴趣靶标的方法是达到这类目的的合适工具。但是,由于发射光谱宽,以多通道方式研究活细胞过程时可供选择的荧光染料仍然相当有限。每使用一个额外的标签,找到具有高特异性和高信号输出的激发/探测模式就变得更加困难。将两个或多个荧光团信号一起成像时,需要使用复杂的标记策略最大程度减少光谱重叠。
无论使用细胞培养物、类器官、球状体还是较小的模式生物,都必须使用近生理条件来确保样本保持活力。在延时实验中,某些条件必须保持最佳状态,才能确保细胞不仅能够存活,而且不会承受压力,并保持真实的生理机能。通常情况下使用培养箱(37°C、二氧化碳、湿度,有时还包括在一段时间内具有高稳定性的氧气)确保持续提供近生理条件。此外,选择一种低自发荧光、不会干扰信号且不影响成像的介质也大有好处。
在活细胞实验中,高速采集通常至关重要,特别是在研究快速动态过程时,如囊泡观察。使用滤光片会导致速度受限,因为在改变每种颜色的滤光片组时必须依次成像。按顺序采集图像比同时采集图像需要更多时间,因此在采集过程中可能会错过样本的快速运动,因为从一个图像到下一个图像时每种颜色都有更长的时间间隔。此外,当两种或多种颜色之间的直接比较至关重要时,例如在上述囊泡观察实验中:信号甚至可能在两次荧光团采集之间已经移动,从而加大数据解释的难度。
1.T. Zimmermann,《生物化学工程进展/生物技术》2005, 95, 245
2.F. Fereidouni、A. N. Bader、H. C. Gerritsen《Opt.Express》2012, 20, 12729。
3.Francesco Cutrale、Vikas Trivedi、Le A Trinh、Chi-Li Chiu、John M Choi、Marcela S Artiga 和 Scott E Fraser,高光谱相量分析可实现多通道 5D 体内成像, 《自然·方法学》14, 149–152 (2017) doi:10.1038/nmeth.4134


