跳至内容
生物样品的荧光标记可以说占据了生命科学研究的很大分量。而荧光成像在生命科学的显微成像工作中更是占据了极大比例。常规荧光、共聚焦、超分辨等等技术都是以荧光作为基础。所以荧光原理、荧光显微镜基本组成、荧光光谱及荧光染料的选择成为了每一位生命科学工作者所必须了解的内容。下面我们将尽量简明的介绍与此相关的一些概念与原理,期望可以让您在最短的时间内掌握关于荧光的种种!
具备荧光现象的物质,可以称作荧光物质。在生命科学研究中常接触的有荧光染料、荧光二抗、荧光蛋白等。这些当中真正可以发射荧光的分子我们可以称为荧光基团。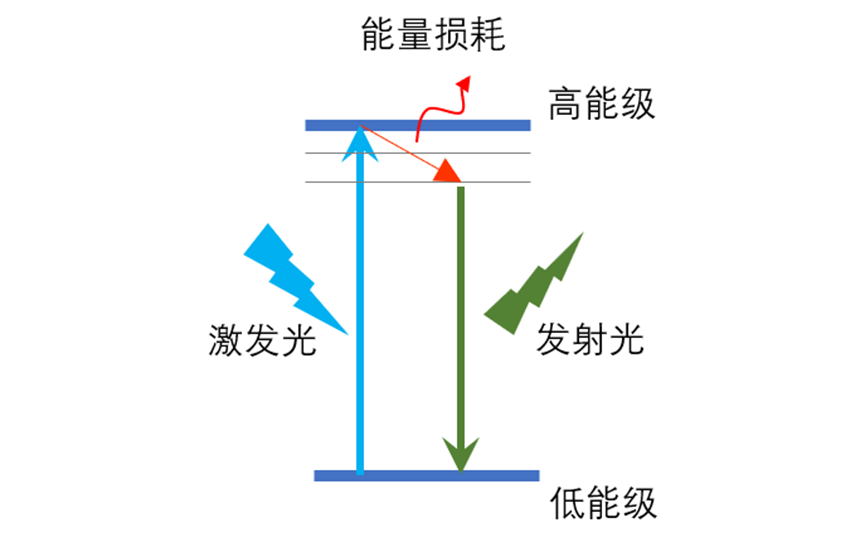 荧光现象:大家往往用上图的形式来表达这一现象。分子中的电子运行在不同的轨道上,不同轨道上的电子由于能量不同而称为不同的能级。当某一特定能量的光子打到分子上,低能级的电子可能吸收这个光子,从而因获得了能量进而跃迁到高能级。电子在高能级不稳定,如果再次跃迁回低能级就会释放出一份能量,这一份能量是以电磁辐射的形式释放的(电磁波),当这一电磁波的波长处于可见光波段时(400-700nm) 就被称为荧光现象。这时分子吸收的光称为激发光,发出的光称为发射光。
由于能量损耗的存在,一般发射光的能量会比激发光低一些,所以发射光的波长大都长于激发光。也因此我们见到的荧光现象就会有紫光激发发射蓝光、蓝光激发发射绿光、绿光激发发射红光……
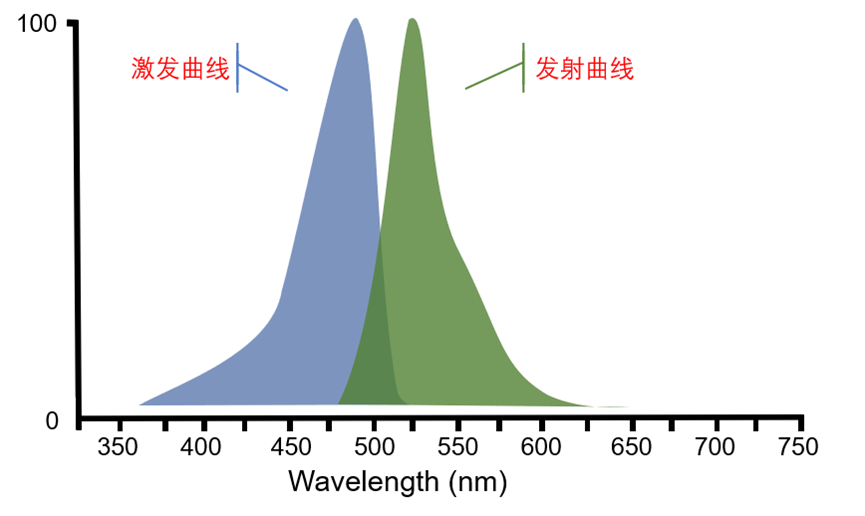
一种荧光基团的荧光特性,可以用下图的光谱曲线表示。
图中蓝色为激发光曲线,绿色为发射光曲线,横坐标表示光的波长,纵坐标表示激发和发射光的相对强度。曲线中可以很方便地看出较短的激发光激发出了较长波段的发射光。
这里需要留意的是激发与发射的纵坐标实际表示不同的含义。激发曲线的纵坐标表示不同波长光线激发对应荧光基团的激发效率,其最高处为激发效率最高的波长,而其他位置是相对于最高激发效率的百分比。所以激发曲线也可以称为激发效率曲线。
而发射曲线纵坐标为不同波长发射光的亮度分布,其最高处表示对应波段的发射光亮度最高,其他区域为不同波段亮度相对于最高亮度的百分比。所以发射曲线也可以称为发射亮度分布曲线。
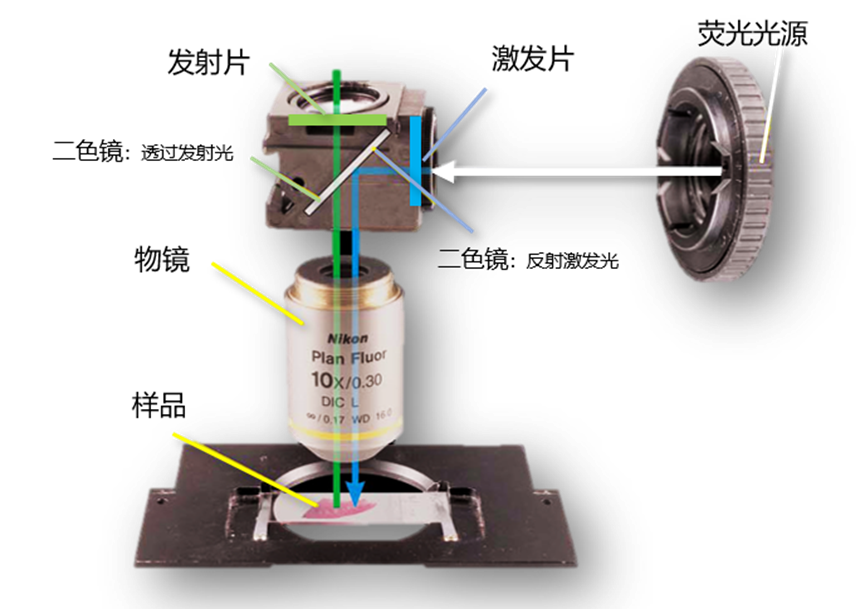
荧光显微镜是如何进行荧光成像的呢?其核心有两个方面,一个是如何分离激发光与发射光,第二个是如何只看到发射光而滤除激发光。我们可以通过下图理解荧光显微镜的成像原理。
以蓝色激发发射绿色荧光为例:来自荧光光源的光线经过激发片过滤,得到蓝色的单色激发光,随后蓝色的激发光照射到成45度放置的二向色镜,反射进入物镜,并照射在样品上。荧光标记的样品吸收能量激发出绿色的荧光,再次经过物镜来到二向色镜的位置(二向色镜是一种特殊的滤色片,其可以选择性地透过一部分光,而反射另一部分),绿色的荧光可以透过二向色镜并穿过发射片,最终到达肉眼或者相机。
正如图中所示,激发片、发射片和二向色镜会安装在一个盒子中,其称为滤光块(filter cube)。我们可以看到荧光成像中起最大作用的部件就是“二向色镜”,可起到分离激发光和发射光的作用。激发片提供对应的波段的激发光,当使用激光光源等窄波段光源时,激发片并不是必须的。发射片看起来会有些多余,仿佛二向色镜就已经滤除了激发光。但实际上由于激发光的光强远大于发射光,少量遗漏的反射激发光都会干扰成像质量,所以发射片可以滤除激发光的干扰进而得到极低背景的荧光图像。
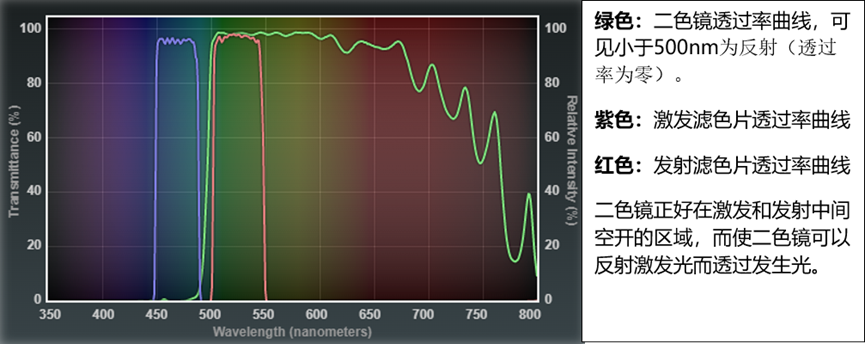
滤色块由二色镜(DM),激发滤片(EX)和发射/阻挡滤片(EM/BA)构成。他们的波长一般用下图的三条透过率曲线表示。
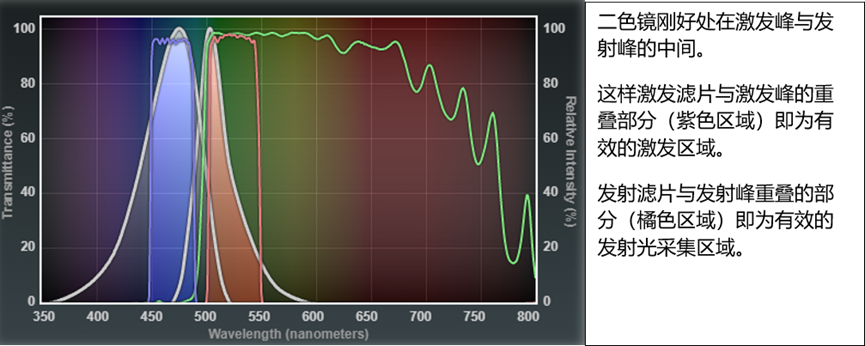
利用此图我们可以很方便的和荧光基团的激发发射曲线叠加,如下图。
由上一节的论述可知荧光光路的交汇点——滤色块,起到非常重要的作用。我们也可以把滤色块作为荧光显微镜中的核心组成。
倒置显微镜荧光光路:来自荧光光源的激发光,通过物镜下方的滤色块反射到样品。样品发出的荧光向下再次经过滤色块最终经过目镜或相机进行观察。
正置显微镜荧光光路:来自荧光光源的激发光,通过物镜上方的滤色块反射到样品。样品发出的荧光向上再次经过滤色块最终经过目镜或相机进行观察。
我们希望您在使用荧光显微镜的时候可以将显微镜的光路映射在大脑中,这样整个成像工作都将变得轻松明了!
良好的荧光图像并不只是取决于信号的大小。请看下图两个同样的星空,在灯光的干扰下,右图的天空只能看到几颗星星,非常不易观察了。可知背景噪声对信号的巨大影响。
尤其对于荧光信号,由于其强弱很难提高,所以对于降低荧光信号中的噪声就变得非常重要了。准确来说噪声主要有两个来源,一个是成像系统自身的噪声,另一个是外界光线干扰而带来的噪声。所以在荧光成像中一般要求避光的环境以降低环境光线带来的干扰。
生命科学中常见的荧光基团可以分为三类:荧光染料、荧光抗体、荧光蛋白。
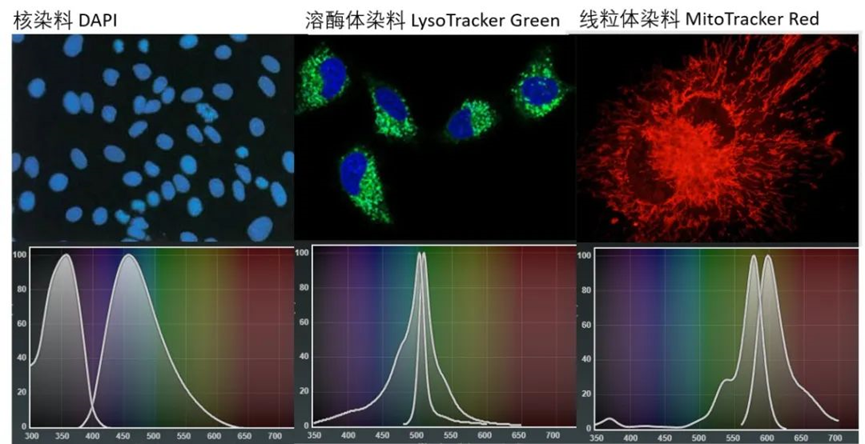
此类物质可以相对特异地和细胞中的某些成分结合,并且其自身就具备荧光特性。这一类最为常用的就是DAPI,其使用非常方便,相应的浓度直接加入样品中即可。
此类荧光染料还有很多应用,比如常用的线粒体标记MitoTracker。同样不需要荧光二抗的免疫标记和荧光蛋白的基因操作。
自然易用的荧光染料也有其局限性。一个是特异性不够,无法精确到单一成分的水平,并且会一定程度地出现非特异染色的情况。另一个是标记种类的局限,很多细胞组分并没有合适的对应荧光染料。
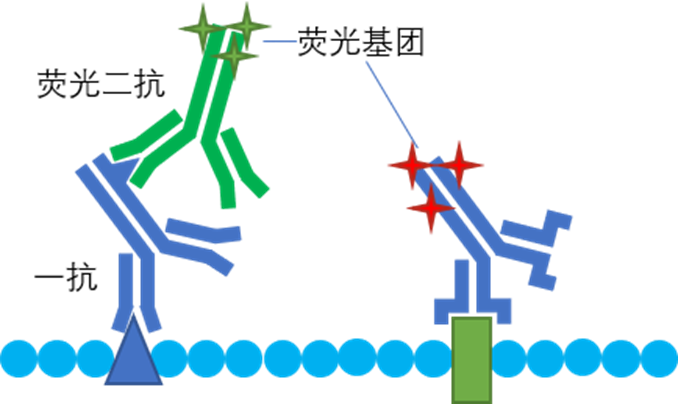
免疫荧光技术的应用是非常普遍的,其真正发出荧光的物质是和抗体结合的各类荧光基团。我们将结合了相应荧光基团的抗体称为荧光抗体。实验中最常用的方法是,通过特异性一抗结合目标抗原,再用荧光二抗标记一抗,也有部分研究者直接使用荧光一抗标记样品。
荧光抗体的选择十分丰富,常用的绿色荧光如FITC、Alexa Fluor488;红色的如TRITC、AlexaFluor 568、Cy3;还有远红的如AlexaFluor 647、Cy5。
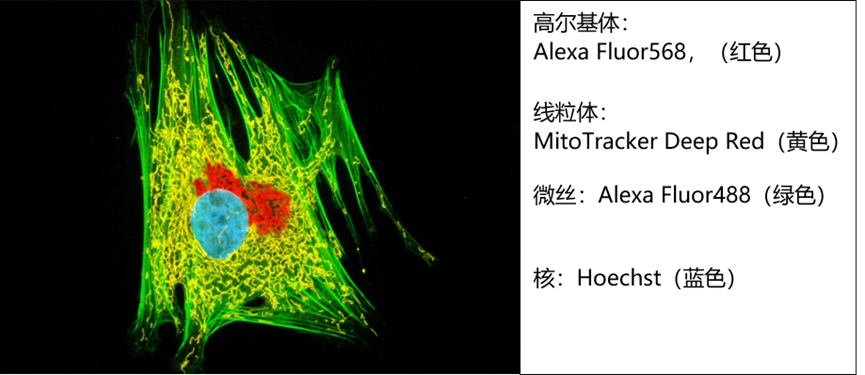
利用不同源性的一抗及二抗的组合可以十分方便的进行样品中多个抗原的多色标记,并进行多色荧光成像。通常研究者还会结合不同的荧光染料以实现三色或者四色的多色荧光成像。
荧光蛋白在荧光成像中的应用同样非常广泛,同时还是活体样品标记的不二选择。如常用的绿色荧光蛋白GFP(Green Fluorescence Protein)、黄色荧光蛋白YFP(Yellow Fluorescence Protein)等。
首先发现GFP的是下村脩 (Osamu Shimomura),他是日本有机化学家兼海洋生物学家。1962年他从美国西海岸近海的一种水母身上分离出了GFP蛋白。此后,由于荧光蛋白不断发展和应用,2008年的诺贝尔化学奖颁发给了下村脩、Martin Chalfie、钱永健 (Roger Tsien)三位科学家,以表彰其在荧光蛋白研究中的突出贡献。
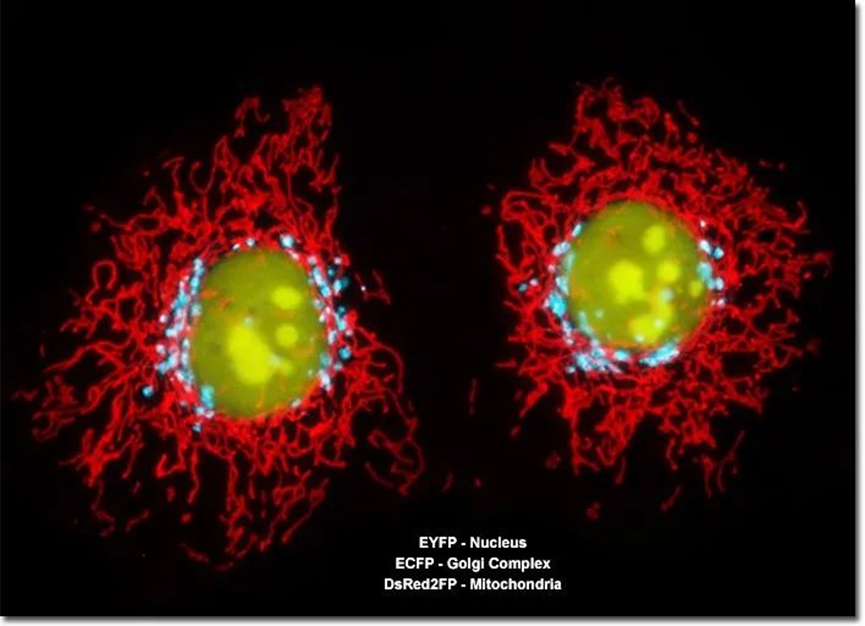
荧光蛋白一般经由基因编辑或者病毒转染的方式表达在细胞或者个体当中。让荧光蛋白基因插入目的基因的合适位点,即可实现对目的基因的荧光示踪。通过组合不同波长的荧光蛋白,也可以同时观察样品中的不同目标,如下图。
荧光技术是如此重要,在整个生命科学的研究中发挥着无可替代的作用,同时在显微成像领域更是处于垄断的地位。除了传统的宽场荧光,点扫描及转盘共聚焦等显微技术外,随着近年来超分辨,光片等多种技术的加入,使荧光技术越发的重要了!
本文试图使用尽量简短的文字,汇总荧光技术最为基础和核心的概念,希望可以为刚刚接触的初学者或者想要较系统了解荧光技术的研究者,提供简洁系统的介绍。愿能对您有些许帮助。
荧光现象:大家往往用上图的形式来表达这一现象。分子中的电子运行在不同的轨道上,不同轨道上的电子由于能量不同而称为不同的能级。当某一特定能量的光子打到分子上,低能级的电子可能吸收这个光子,从而因获得了能量进而跃迁到高能级。电子在高能级不稳定,如果再次跃迁回低能级就会释放出一份能量,这一份能量是以电磁辐射的形式释放的(电磁波),当这一电磁波的波长处于可见光波段时(400-700nm) 就被称为荧光现象。这时分子吸收的光称为激发光,发出的光称为发射光。
由于能量损耗的存在,一般发射光的能量会比激发光低一些,所以发射光的波长大都长于激发光。也因此我们见到的荧光现象就会有紫光激发发射蓝光、蓝光激发发射绿光、绿光激发发射红光……
一种荧光基团的荧光特性,可以用下图的光谱曲线表示。
图中蓝色为激发光曲线,绿色为发射光曲线,横坐标表示光的波长,纵坐标表示激发和发射光的相对强度。曲线中可以很方便地看出较短的激发光激发出了较长波段的发射光。
这里需要留意的是激发与发射的纵坐标实际表示不同的含义。激发曲线的纵坐标表示不同波长光线激发对应荧光基团的激发效率,其最高处为激发效率最高的波长,而其他位置是相对于最高激发效率的百分比。所以激发曲线也可以称为激发效率曲线。
而发射曲线纵坐标为不同波长发射光的亮度分布,其最高处表示对应波段的发射光亮度最高,其他区域为不同波段亮度相对于最高亮度的百分比。所以发射曲线也可以称为发射亮度分布曲线。
荧光显微镜是如何进行荧光成像的呢?其核心有两个方面,一个是如何分离激发光与发射光,第二个是如何只看到发射光而滤除激发光。我们可以通过下图理解荧光显微镜的成像原理。
以蓝色激发发射绿色荧光为例:来自荧光光源的光线经过激发片过滤,得到蓝色的单色激发光,随后蓝色的激发光照射到成45度放置的二向色镜,反射进入物镜,并照射在样品上。荧光标记的样品吸收能量激发出绿色的荧光,再次经过物镜来到二向色镜的位置(二向色镜是一种特殊的滤色片,其可以选择性地透过一部分光,而反射另一部分),绿色的荧光可以透过二向色镜并穿过发射片,最终到达肉眼或者相机。
正如图中所示,激发片、发射片和二向色镜会安装在一个盒子中,其称为滤光块(filter cube)。我们可以看到荧光成像中起最大作用的部件就是“二向色镜”,可起到分离激发光和发射光的作用。激发片提供对应的波段的激发光,当使用激光光源等窄波段光源时,激发片并不是必须的。发射片看起来会有些多余,仿佛二向色镜就已经滤除了激发光。但实际上由于激发光的光强远大于发射光,少量遗漏的反射激发光都会干扰成像质量,所以发射片可以滤除激发光的干扰进而得到极低背景的荧光图像。
滤色块由二色镜(DM),激发滤片(EX)和发射/阻挡滤片(EM/BA)构成。他们的波长一般用下图的三条透过率曲线表示。
利用此图我们可以很方便的和荧光基团的激发发射曲线叠加,如下图。
由上一节的论述可知荧光光路的交汇点——滤色块,起到非常重要的作用。我们也可以把滤色块作为荧光显微镜中的核心组成。
倒置显微镜荧光光路:来自荧光光源的激发光,通过物镜下方的滤色块反射到样品。样品发出的荧光向下再次经过滤色块最终经过目镜或相机进行观察。
正置显微镜荧光光路:来自荧光光源的激发光,通过物镜上方的滤色块反射到样品。样品发出的荧光向上再次经过滤色块最终经过目镜或相机进行观察。
我们希望您在使用荧光显微镜的时候可以将显微镜的光路映射在大脑中,这样整个成像工作都将变得轻松明了!
良好的荧光图像并不只是取决于信号的大小。请看下图两个同样的星空,在灯光的干扰下,右图的天空只能看到几颗星星,非常不易观察了。可知背景噪声对信号的巨大影响。
尤其对于荧光信号,由于其强弱很难提高,所以对于降低荧光信号中的噪声就变得非常重要了。准确来说噪声主要有两个来源,一个是成像系统自身的噪声,另一个是外界光线干扰而带来的噪声。所以在荧光成像中一般要求避光的环境以降低环境光线带来的干扰。
生命科学中常见的荧光基团可以分为三类:荧光染料、荧光抗体、荧光蛋白。
此类物质可以相对特异地和细胞中的某些成分结合,并且其自身就具备荧光特性。这一类最为常用的就是DAPI,其使用非常方便,相应的浓度直接加入样品中即可。
此类荧光染料还有很多应用,比如常用的线粒体标记MitoTracker。同样不需要荧光二抗的免疫标记和荧光蛋白的基因操作。
自然易用的荧光染料也有其局限性。一个是特异性不够,无法精确到单一成分的水平,并且会一定程度地出现非特异染色的情况。另一个是标记种类的局限,很多细胞组分并没有合适的对应荧光染料。
免疫荧光技术的应用是非常普遍的,其真正发出荧光的物质是和抗体结合的各类荧光基团。我们将结合了相应荧光基团的抗体称为荧光抗体。实验中最常用的方法是,通过特异性一抗结合目标抗原,再用荧光二抗标记一抗,也有部分研究者直接使用荧光一抗标记样品。
荧光抗体的选择十分丰富,常用的绿色荧光如FITC、Alexa Fluor488;红色的如TRITC、AlexaFluor 568、Cy3;还有远红的如AlexaFluor 647、Cy5。
利用不同源性的一抗及二抗的组合可以十分方便的进行样品中多个抗原的多色标记,并进行多色荧光成像。通常研究者还会结合不同的荧光染料以实现三色或者四色的多色荧光成像。
荧光蛋白在荧光成像中的应用同样非常广泛,同时还是活体样品标记的不二选择。如常用的绿色荧光蛋白GFP(Green Fluorescence Protein)、黄色荧光蛋白YFP(Yellow Fluorescence Protein)等。
首先发现GFP的是下村脩 (Osamu Shimomura),他是日本有机化学家兼海洋生物学家。1962年他从美国西海岸近海的一种水母身上分离出了GFP蛋白。此后,由于荧光蛋白不断发展和应用,2008年的诺贝尔化学奖颁发给了下村脩、Martin Chalfie、钱永健 (Roger Tsien)三位科学家,以表彰其在荧光蛋白研究中的突出贡献。
荧光蛋白一般经由基因编辑或者病毒转染的方式表达在细胞或者个体当中。让荧光蛋白基因插入目的基因的合适位点,即可实现对目的基因的荧光示踪。通过组合不同波长的荧光蛋白,也可以同时观察样品中的不同目标,如下图。
荧光技术是如此重要,在整个生命科学的研究中发挥着无可替代的作用,同时在显微成像领域更是处于垄断的地位。除了传统的宽场荧光,点扫描及转盘共聚焦等显微技术外,随着近年来超分辨,光片等多种技术的加入,使荧光技术越发的重要了!
本文试图使用尽量简短的文字,汇总荧光技术最为基础和核心的概念,希望可以为刚刚接触的初学者或者想要较系统了解荧光技术的研究者,提供简洁系统的介绍。愿能对您有些许帮助。