哺乳动物细胞培养是生命科学的基本支柱之一。如果不具备在实验室中培养细胞的能力,那么细胞生物学、免疫学、肿瘤研究等学科很难实现快速发展。本文概述了哺乳动物细胞培养系统,可以根据其形态、细胞类型和组织对其进行分类。此外,还介绍了适宜的细胞生长条件以及需要使用何种显微镜来观察细胞。
形态学 哺乳动物细胞培养系统可根据几种不同的特征进行细分。最明显的特征是细胞的形态。根据显微镜下观察到的外观,我们可以区分成纤维细胞或成纤维细胞样细胞、上皮样细胞和淋巴母细胞样细胞。
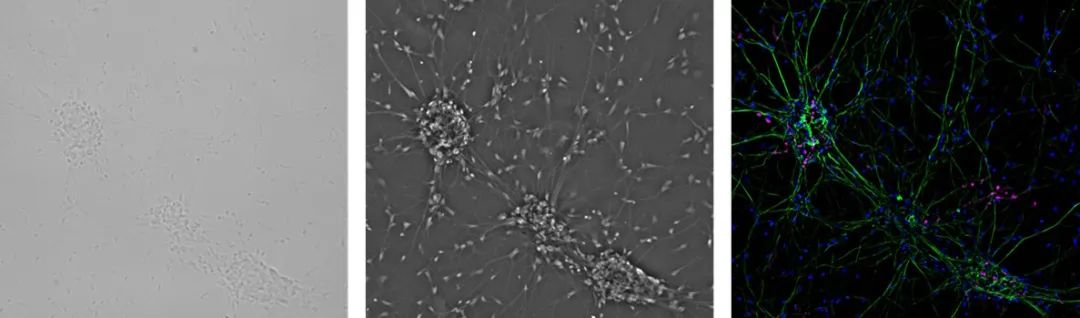
成纤维细胞或成纤维细胞样细胞为双极或多极细胞,呈细长形(图1)。它们生长附着在细胞基质上,并经常对齐成平行排列。在活生物体中,成纤维细胞分泌细胞外基质,并且是结缔组织的一部分。此外,神经元细胞由于其多极形状而可以排列在成纤维细胞样细胞中。
上皮样细胞呈多边形,一般尺寸较为规则,贴附在基质上呈散斑片状生长(图1)。上皮样细胞的细胞膜在不同子区域间表现为完全不同的结构与功能,顶膜面对培养基,而基底外侧膜在单个细胞和培养容器之间扩散。两个膜结构域均通过紧密连接而分开。在体内,上皮细胞排列在身体结构上。
淋巴母细胞样细胞呈球形,通常在悬浮液中生长(图1)。与成纤维细胞或上皮样细胞不同,淋巴母细胞样细胞不附着在表面上。血细胞就是非常典型的淋巴母细胞样细胞。 图1:哺乳动物细胞可根据其形态进行区分。成纤维细胞(左)呈双极或多极形状。上皮样细胞(中间)尺寸更为规则,淋巴母细胞样细胞(右)为圆形,悬浮生长。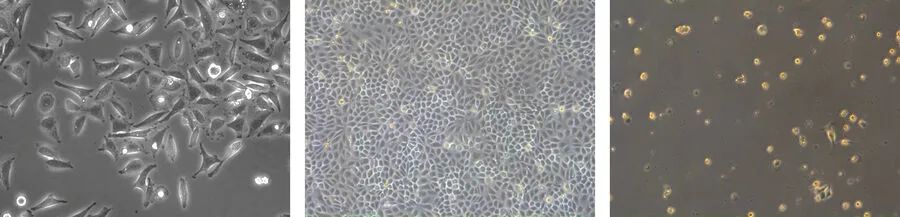
细胞类型 哺乳动物细胞培养系统的另一个区别是使用的细胞类型。根据其起源,细胞可细分为永生化细胞系、原代细胞和干细胞(包括患者特异性细胞)。
使用中最常见的细胞类型可以追溯到永生化细胞,这些细胞要么来源于癌组织,要么转染了癌基因。由于它们的恶性本质,它们将无限分裂。这一事实使得它们作为细胞系非常易于培养。具有稳健性,并且可以负担。
另一方面,人们应该考虑到它们突变的遗传背景,很难再接近自然。一个突出的例子是来源于宫颈癌的HeLa细胞系。与正常人细胞的46条染色体相比,其细胞核约有80条染色体。其他常用的永生化细胞系有HEK、A549、Jurkat、MDCK、COS或Vero细胞。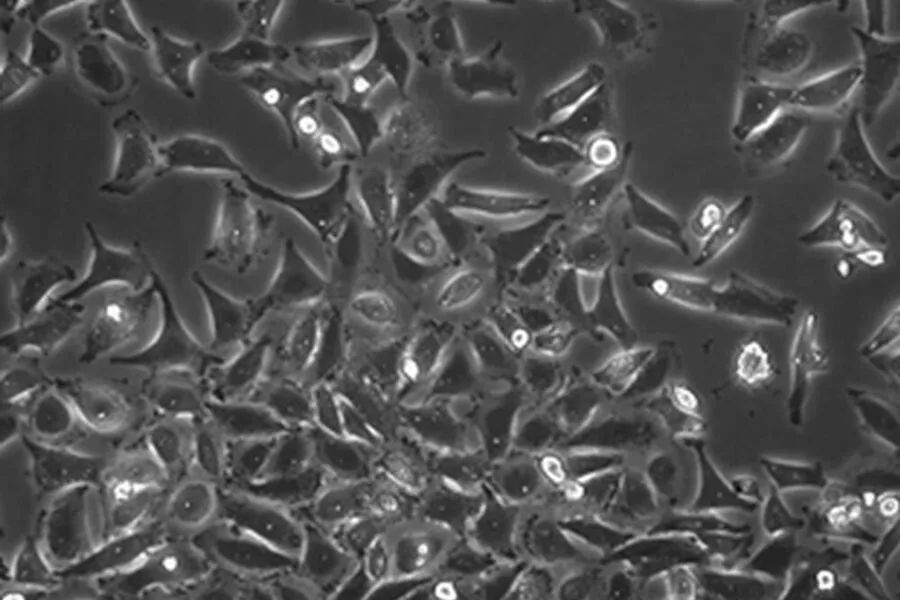
原代细胞直接取自活组织。培养时,将原始组织片段通过酶解、化学或机械解离成单细胞,可接种于培养瓶中。原代细胞比永生化细胞系更难培养。原代细胞的存活率很低,很多没有分裂。而且,它们的遗传操作可能具有挑战性。然而,因为它们的特征更接近自然细胞,所以遗传操作是有意义的。换句话说,用原代细胞获得的科学结果可以更有把握地转化为体内世界。
干细胞是人体的始祖细胞。它们可以从非特化细胞分化为具有专用特性和功能的特化组织细胞。因此,它们被分为几类。多潜能干细胞是最通用的,能够分化成任何一种身体细胞。与多潜能干细胞相比,多能干细胞表现出有点有限的分化范围。双能干细胞只能发育成两种不同的细胞类型。干细胞除了分化成特化的细胞类型外,还可以分裂,即可以自我更新。
干细胞的来源各不相同。通常它们是从胚胎中获取,称为胚胎干细胞。其他可以从某些组织中提取,例如骨髓中含有造血干细胞。这些类型的细胞称为“组织特异性”或“成体”干细胞。由于伦理问题,从活体动物或人类中获得干细胞很难证明其合理性。因此,人们对诱导已经分化的机体细胞转化为干细胞的机上产生了很多兴趣。体细胞只能通过转染4个基因(c-Myc、klf-4、oct-4、sox-2)进行重编程,得到所谓的 诱导多能干细胞 (iPSC)。
虽然与干细胞合作具有挑战性,但它们给了研究人员最高的灵活性。像某些营养物质和生长因子一样,根据细胞培养基中包含的成分,干细胞可以被触发,发育成一种截然不同的细胞类型,例如神经元。
因为研究人员能够获得疾病特异性甚至患者特异性细胞来寻找治愈方法,诱导多能干细胞具有非常重要的意义,尤其是在临床环境中。这种个性化医疗有望提供非常有效的疗法。
细胞培养组织 上述所有不同的细胞类型可以以不同的方式生长。例如,细胞培养物可由单个细胞类型或各种细胞类型组成。而且,细胞可以以2D或3D方向组织。
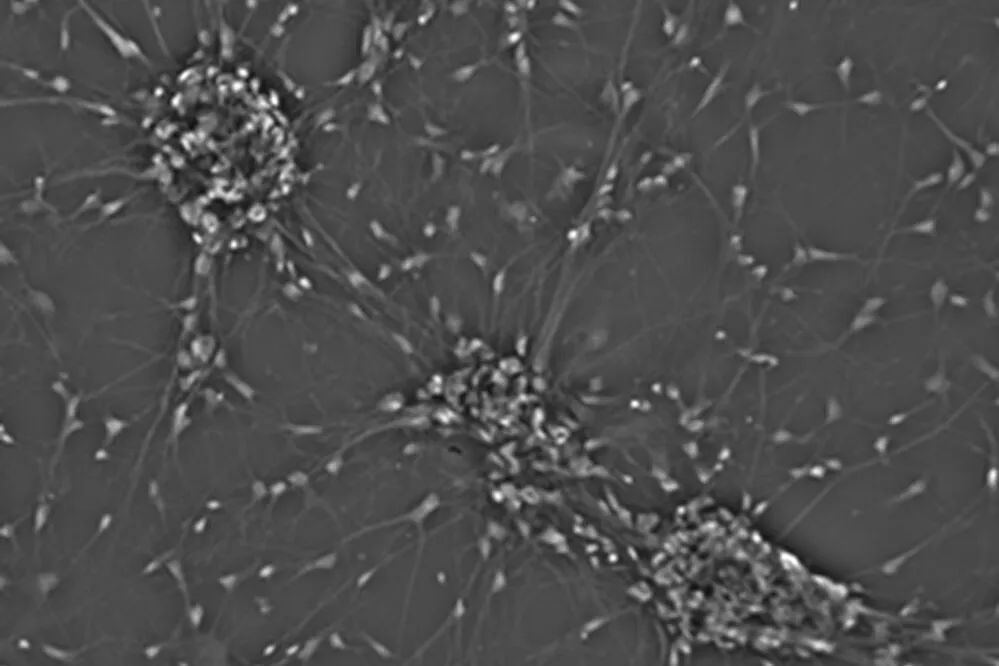
培养细胞最简单的方法是在普通培养皿中,细胞在单层细胞的底部生长(图4)。这样的单一培养单一细胞类型操作简单。因此,HeLa、MDCK、HEK等细胞在经典容器中培养,几乎可以在每个细胞生物学实验室中找到它们。另一方面,2D单培养也是人工最常用的维持细胞方式。有两个主要论点支持这一结论:1)在活生物体中,细胞在三维中生长。2)它们的生长与其他细胞类型相关。
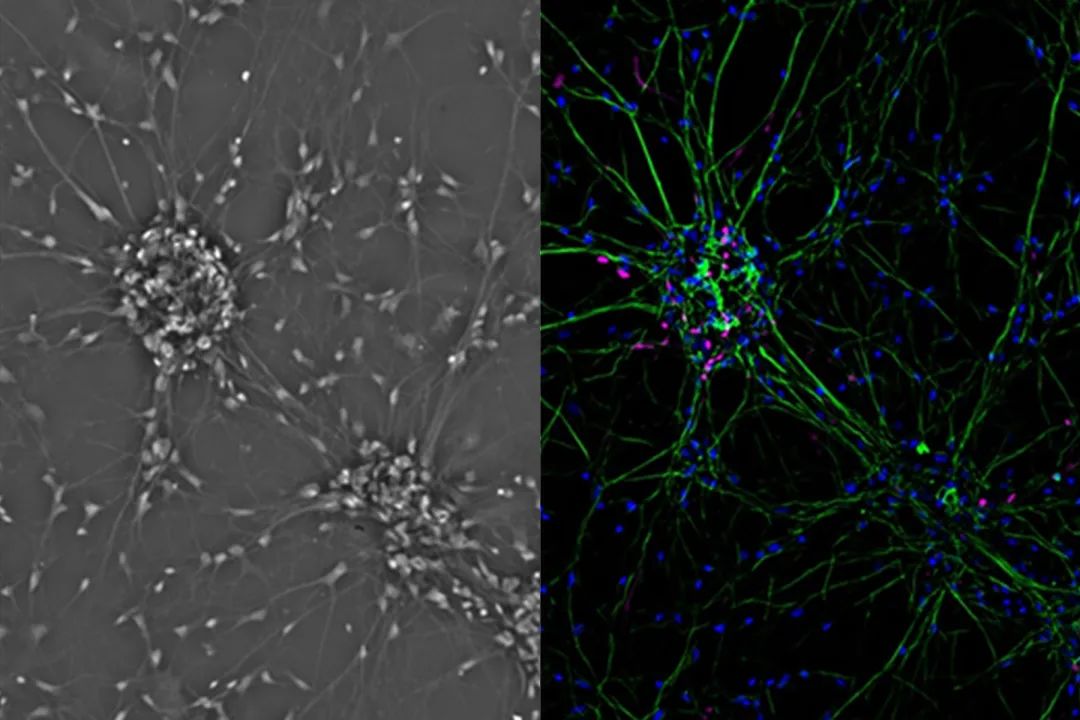
更接近自然的一步将是在二维上共培养几种细胞类型。共培养细胞系的示例为神经元原代培养物,即神经胶质细胞与神经元一起生长(图4)。
细胞生物学家要应用某些技巧来进入3D世界。其中之一是移除细胞,使之不粘附在底物上。这可以通过使用具有特殊涂层的细胞培养容器,或使用基质胶(例如Matrigel™),或通过在“悬滴”中培养细胞来实现。简而言之,如果细胞不能粘在培养器皿上,它们就会相互粘在一起。因此,几千个单细胞可以粘附形成直径为200-1000µm的球体。这类物体组织更为写实,包括自然组织中常见的代谢和增殖梯度(图4)。由于这种组织,球体常用于发现药物,因为它们精确地模拟了无血管肿瘤。 图4:哺乳动物细胞培养组织可细分为几类。最简单的方式是在二维(a)中培养单个细胞类型。通过在二维(b)共培养几种细胞类型,可以达到更自然的状态。对于3D细胞培养,细胞必须生长于特殊容器或基质中(c)。几种细胞类型的3D培养是最现实的模型系统(d)。 另一种在3D环境中培养细胞的更现实的方法是使用支架。由金属、聚合物或陶瓷制成的基质可用于帮助细胞蠕变成三维形式。这些支架可用作临床植入物或用于实验室。
在器官芯片中实现了一种类似的原理,器官芯片由定植于各种细胞类型的微流控装置组成。微流控装置可以有多个腔室,可以连续灌注。通过这种排列,研究人员可以在组织和器官水平上模拟生理情况。额外使用膜和可伸展材料可导致产生与自然具有惊人相似性的人工结构,例如模拟呼吸或转移等动态过程。
另一个非常现实的细胞培养组织是基于干细胞,在细胞外基质凝胶内存在不同生长因子的情况下进行培养。根据生长因子的类型(如成纤维母细胞生长因子、表皮生长因子等)和其他成分干细胞发育成类器官的迷你器官(图4)。它们与“成熟”的对应物非常相似,表现出器官型发育和器官特异性功能。因此脑、胃、肝、肠等类器官可用于研究疾病和器官发育或发明药物和毒理学研究。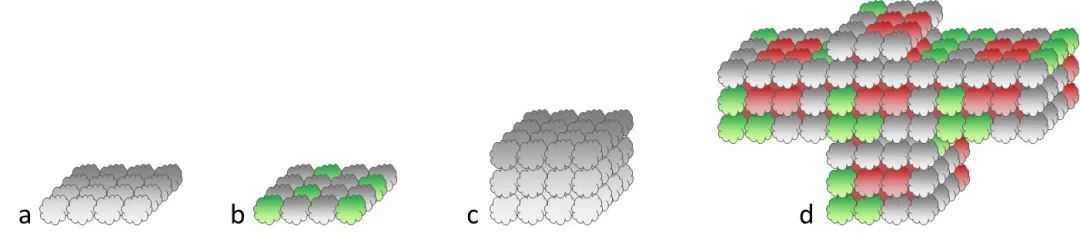
生长条件 哺乳动物细胞培养物必须维持在37 ℃的温度下。它们通常在特殊一次性塑料容器中培养,容器形状和大小各异(图5)。其中最小的是96孔板,通常用于筛选。还有开发用于大规模生产疫苗或蛋白质的细胞工厂(图6)。使用细胞培养物意味着在无菌条件下进行操作,例如在洁净工作台上使用抗生素。此外,必须为其提供含有营养物质和生长因子的适当培养基。其中包括: 由于其不稳定性,氨基酸谷氨酰胺通常以稳定形式加入。蛋白质、脂质或生长因子通常以胎牛血清的形式进行补充。
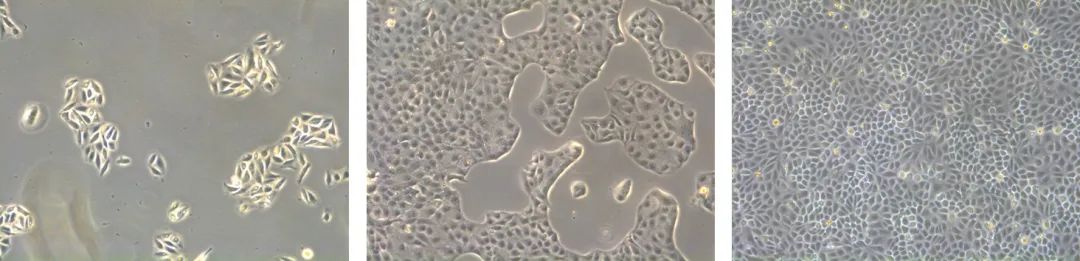
细胞的代谢产物使培养基酸化。因此,使用缓冲系统维持平衡pH值(约7.4)。通常通过指示剂酚红监测pH值。一般使用碳酸氢盐(HCO3-)缓冲液。它们结合质子(H+离子)的能力取决于周围的CO2水平。为此,细胞培养培养箱通常提供CO2。HEPES缓冲液不依赖于CO2,通常用于不适用CO2孵育活的细胞显微镜检查。 图5:通常用于哺乳动物细胞培养的容器(左)。一些显微镜为各种容器提供了带有专用固定框架的物镜导轨(右)。

细胞培养和显微镜检查 说到用于细胞培养的显微镜,其必须具备某些基本特征。哺乳动物细胞在液体培养基中培养,意味着显微镜必须具有倒置的配置。在这种配置中,物镜安装在培养皿下方,培养皿放置在显微镜载物台上,聚光镜安装在上方。只有采用这种设置,物镜才能足够接近样品。而且,这种构造使研究人员用在样品周围有更多的自由空间(图6)。 图6:只有倒置显微镜(物镜位于样品下方,聚光镜位于样品上方)才能保证物镜的位置足够靠近样品。此外,这种设置需要在标本上方保留更多的空间,才可以将整个细胞工厂放到载物台上。 为了解细胞培养物的总体状态,放大100-200倍即可。哺乳动物细胞的低内在对比度要求显微镜提供特定的对比度方法。相差和调制相差是最常见的,而微分干涉对比(DIC)与通常用于细胞培养的塑料容器不兼容(图7)。 图7:哺乳动物细胞固有的对比度较低,简单的明场显微镜(左)观察效果不佳。相差(中间)等对比度方法能够实现清晰的可视化。对于荧光显微镜检查(右),成像前必须用荧光标记物转染细胞。 通过这种基本设备,研究人员可以判断细胞数量和融合情况(图8)。后者描述了培养容器中的定植程度(%)。根据融合情况,必须将细胞传代培养到更多容器中。 图8:细胞融合表示为细胞过度生长的面积百分比。这些图像上列从左到右显示:15%融合、60%融合和100%融合。下列是Leica最新推出的Mateo TL自带的汇合度分析功能,能以统一的标准来判断汇合度,从而最大程度减少主观误差。 如果研究人员不仅想快速查看细胞,还想记录细胞培养状况,那么一台配备了相机的显微镜是必要的。而且,哺乳动物细胞经常转染荧光蛋白的基因。为了检查转染率,显微镜必须具有荧光照明能力,意味着需要荧光光源加上相关的滤色片。